A imprescindibilidade da transparência e da adequada fundamentação no processo de incorporação de tecnologias no SUS
Para que o processo administrativo seja aprimorado, o Poder Judiciário pode exercer importante papel, desde que demandado, produzindo o controle de atos, preferencialmente em processos coletivos.
quinta-feira, 24 de outubro de 2019
Atualizado às 10:24
1. A Conitec e o processo de incorporação de tecnologia
A regulamentação do fluxo do processo de incorporação de tecnologias em saúde é relativamente recente no Sistema Único de Saúde. O primeiro ato normativo a tratar do tema foi a portaria 152/GM, de 19 de janeiro de 2006.
1.1 A Citec - Comissão para Incorporação de Tecnologias do Ministério da Saúde
Num primeiro momento, a atribuição da gestão do processo de incorporação ficou a cargo da Secretaria de Atenção à Saúde (SAS) e a gestão de avaliação das tecnologias de interesse para o SUS, a cargo da Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE), conforme estabeleceu seu art. 1º, § 2º.
A mesma portaria, em seu art. 2º, caput, instituiu a CITEC - Comissão para Incorporação de Tecnologias do Ministério da Saúde, com a "missão de encaminhar o processo de admissibilidade de tecnologias em consonância com as necessidades sociais em saúde e de gestão do SUS".
Com a portaria 2.587, de 30 de outubro de 2008, a CITEC passou a ser vinculada à SCTIE.
1.2 A Conitec - Comissão Nacional de Incorporação de Tecnologias no SUS
Posteriormente, a lei 12.401/11 criou a CONITEC - Comissão Nacional de Incorporação de Tecnologias no SUS, que substituiu a CITEC. Regulamentando a referida lei, o decreto 7.646/11 tratou da composição e estrutura da CONITEC, bem como do novo processo de incorporação. Atualmente, a CONITEC é o órgão que promove as avaliações de tecnologias em saúde (ATS).
1.3 O processo de incorporação
O art. 3º, do decreto, que trata das diretrizes da CONITEC, prevê que o processo privilegiará "a incorporação de tecnologias por critérios racionais e parâmetros de eficácia, eficiência e efetividade adequados às necessidades de saúde" (inciso III), bem como "a incorporação de tecnologias que sejam relevantes para o cidadão e para o sistema de saúde, baseadas na relação de custo-efetividade" (inciso IV).
Seu art. 15 expressamente estatui que a incorporação, a exclusão ou a alteração de tecnologias em saúde serão precedidas de processo administrativo.
O processo se inicia com o requerimento para incorporação e alteração de tecnologia ou para a constituição ou alteração de protocolos clínicos de diretrizes terapêuticas pelo interessado (art. 15, § 1º, do decreto 7.646/11). A rigor, qualquer pessoa, física ou jurídica, pode fazer esse requerimento. Todavia, o decreto elenca requisitos que tornam a CONITEC quase inacessível àqueles que não possuam capacidade financeira ou técnica para cumpri-los. A título de exemplo, para a iniciativa, exigem-se estudos econômicos que praticamente só são feitos pelas indústrias farmacêuticas. Mais adiante, ao analisar quem são os demandantes de processos de incorporação, ficará bem clara a dificuldade de acesso à CONITEC.
Analisada a proposta de incorporação, caso se verifique que ela preenche os requisitos previstos no decreto, será feito um relatório considerando as evidências científicas, a avaliação econômica e o impacto orçamentário (art. 18).
Em seguida, o relatório será submetido à consulta pública (art. 19) e, se for o caso, à audiência pública (art. 21). Por fim, um relatório final é elaborado e enviado para a SCTIE (art. 20).
A decisão de incorporação ou não é tomada pelo Secretário de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde (art. 23). Em face dessa decisão, caberá recurso ao próprio Secretário ou ao Ministro da Saúde (art. 26).
2. A natureza dos atos de processo de incorporação de tecnologias
2.1 Atos administrativos
Os atos da CONITEC são atos administrativos, na medida em que são produzidos no desempenho de função administrativa por agente estatal ou por quem esteja em seu lugar. Sendo assim, para que tenham validade, esses atos devem respeitar os princípios do direito administrativo, no que diz respeito a todos os seus aspectos: competência, forma, conteúdo, motivo e finalidade.
2.2 Existência de falhas e o aperfeiçoamento da atuação da Conitec
Ocorre que, por vezes, encontram-se falhas - que serão abordadas adiante - nos relatórios elaborados pela CONITEC, o que pode ser justificado em face da sua recente criação.
Ao contrário de outros órgãos e agências de avaliação de tecnologias em saúde no mundo, a CONITEC não possui nem uma década de existência.
2.3 O papel do Judiciário
Dessa forma, assim como outras agências tiveram sua atuação aperfeiçoada ao longo das décadas, o fenômeno também deve ocorrer com a CONITEC. É o que demonstra o autor Daniel Wang, especificamente em relação ao sistema de saúde inglês, o NHS, National Health Service1.
Do texto do citado autor, extrai-se que o aperfeiçoamento das decisões do NHS se deveu muito à atuação do Poder Judiciário, que compeliu o sistema de saúde a dar mais clareza, transparência e racionalidade às suas decisões, sempre com o objetivo de exigir que fossem declinadas as reais razões para que uma tecnologia fosse ou não incorporada.
Todavia, no Reino Unido, os juízes, ao invés de proferir decisões concedendo tecnologias pleiteadas em ações individuais, questionavam o próprio processo de incorporação, o que forçou que o sistema de saúde trouxesse mais elementos às suas decisões (por quê, como e o quê), a fim de se diminuir o risco de serem revisadas pelo Judiciário.
Em suas conclusões, o autor assim se manifesta:
"First, a comprehensive account of the judicial decisions in cases related to health care rationing in this article challenges the idea that English courts tend to be deferential to authorities when it comes to administrative decisions involving discretionary allocative decisions in social policies. Whilst it is true that courts have very rarely interfered directly on the outcome of a policy by, for instance, ordering the provision of a treatment, they have definitely not shied away from holding authorities to account by continuously requiring better reasons and procedural fairness."
3. A pesquisa realizada
Levando em consideração a premissa de que o exame dos atos administrativos já praticados pode propiciar elementos concretos para a avaliação da qualidade das decisões, procedeu-se à análise de 64 relatórios de recomendações da CONITEC, referentes a medicamentos, dos anos de 2018 e 2019. O intuito do estudo foi apurar eventuais falhas em relatórios, para que elas possam ser corrigidas e evitadas futuramente.
Da análise feita, pode-se ressaltar que foram encontradas situações que chamam a atenção em ao menos 16 relatórios de 2018 e em 1 relatório de 2019. Percebe-se que os relatórios de 2019 já estão mais adequados e mais bem fundamentados, o que evidencia a boa intenção do CONITEC e a evolução na sua atuação.
Com base nesse levantamento, há atitudes e cuidados que devem ou podem ser tomados a fim de que o processo se desenvolva plenamente conforme as regras do direito administrativo.
Ressalte-se que não há dúvidas de que há questões atinentes à incorporação de tecnologias que são eminentemente técnicas e que fogem da área de conhecimento de juristas. Em razão disso, o enfoque dado na pesquisa se refere unicamente às consequências jurídicas dos atos praticados pela CONITEC.
4. Os dados colhidos com a pesquisa
4.1 Os demandantes
Num primeiro momento, é relevante mostrar alguns dados colhidos na pesquisa. Com relação ao ente que dá início ao processo de incorporação de tecnologia, pode-se dividir os demandantes em dois grandes grupos: os demandantes usuais e os inusuais.
No primeiro grupo, encontram-se a indústria farmacêutica, que deflagrou 40 processos dos 64 analisados, bem como a própria Secretaria de Ciência, Tecnologia e Insumos Estratégicos, que o fez em relação a 10 processos.
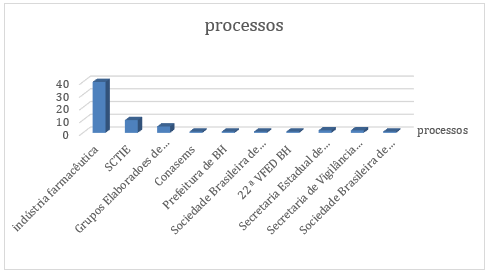
Daí já se percebe que é errônea a justificativa muitas vezes dada por parte do poder público de que, caso a indústria farmacêutica não deflagre o processo de incorporação de tecnologia, nada pode ser feito pelo Ministério da Saúde. Nesse sentido, o próprio decreto 7.646/11 prevê a possibilidade do Ministério da Saúde tomar a iniciativa de processos de incorporação (art. 15, § 4º).
Não se olvida que, nos casos em que a SCTIE deu início ao processo, ela pode ter sido motivada principalmente pela excessiva judicialização de alguns medicamentos, de forma que a análise por parte da CONITEC se mostrou uma forma racional de lidar com o excesso existente. Todavia, isso não afasta a conclusão de que o próprio MS pode, através de seus órgãos, atuar de ofício e provocar a incorporação de tecnologia em outros casos.
Entre os demandantes usuais também figuram os Grupos Elaboradores de PCDTs, que foram responsáveis pelo início de 5 processos de incorporação de medicamentos.
No grupo dos demandantes inusuais estão o Conasems, a Prefeitura de Belo Horizonte, a Sociedade Brasileira de Oncologia, a Sociedade Brasileira de Oncologia Clínica e a 22ª Vara Federal de Belo Horizonte, sendo que cada um desses deflagrou 1 processo de análise pela CONITEC. Ainda, encontram-se a Secretaria Estadual de Saúde de MG e a Secretaria de Vigilância em Saúde, ambas com 2 processos cada.
4.2 Os medicamentos incorporaos com menor custo-efetividade
A relação de custo-efetividade deve ser necessariamente analisada pela CONITEC em seus relatórios, conforme já mencionado.
Geralmente, ele é traduzido pela RCEI (relação de custo-efetividade incremental) por QALY (quality-adjusted life year). O QALY, em linhas gerais, representa o acréscimo que uma tecnologia pode trazer no que diz respeito à quantidade e à qualidade de vida do paciente2. Com esse acréscimo traduzido em termos numéricos, compara-se com o QALY de outro medicamento e obtém-se a RCEI.
Dentre os relatórios analisados, extrai-se que os medicamentos incorporados menos custo-efetivos foram (valores em reais):
1) Alfaelosulfase - RCEI 5 MI/QALY (valor que não considera os 25% de desconto oferecido pela indústria após o relatório preliminar);
2) Galsulfase - RCEI 2,5 MI/QALY (valor que não considera os 25% de desconto oferecido pela indústria após o relatório preliminar);
3) Eculizumabe - RCEI 22.468,00 por quinzena livre de transfusão de sangue;
4) Tafamidis, com RCEI de 974.617,00/QALY;
5) Nusinersena - RCEI 410.783,00 a 749.276,00/QALY, considerando pacientes e cuidadores;
6) Brentuximabe - RCEI 312.927,02/QALY;
7) Adalimumabe para uveíte não infecciosa intermediária, posterior e panuveítes - RCEI 174.000,00 a 311.054,24/QALY.
4.3 Os medicamentos incorporados com maior impacto orçamentário
O impacto orçamentário é outro fator que deve ser necessariamente calculado quando se faz uma avaliação econômica de tecnologia em saúde. Ele representa quais valores serão investidos com a incorporação de uma certa tecnologia, considerando a população beneficiada, os custos embutidos para o seu fornecimento, bem como os custos economizados com a desincorporação de tecnologia que será substituída.
Pela pesquisa feita, os medicamentos incorporados que causaram ou causarão maior impacto orçamentário são (valores em reais):
1) Eculizumabe - de 808 MI a 10,262 BI em 3 anos;
2) Abiraterona - de 223 MI a 2 BI em 5 anos;
3) Nusinersena - 1,2 a 1,6 BI em 5 anos;
4) Galsulfase - 120 a 250 MI em 1 ano (valor que não considera os 25% de desconto oferecido pela indústria após o relatório preliminar);
5) Alfaelosulfase - 150 a 200 MI em 1 ano (valor que não considera os 25% de desconto oferecido pela indústria após o relatório preliminar);
6) Tafamidis - 397,5 MI em 5 anos.
Em vários desses relatórios, a CONITEC consignou que os estudos de impacto orçamentário apresentados pelos demandantes possuíam falhas de diversas ordens, o que leva a crer que, possivelmente, o valor do impacto será ainda maior do que o explicitado.
É interessante notar que, dos seis (6) medicamentos acima citados, cinco (5) são para doenças raras. Com base nisso, depreende-se que, a despeito da população de interesse (pacientes que devem se submeter a determinada terapia) ser reduzida, o custo das terapias para doenças raras é tão alto, que o impacto financeiro causado com a sua incorporação pode ser bastante relevante para o orçamento da saúde.
5. Proposições para o aprimoramento do processo de incorporação de tecnologias
5.1 Exigir o uso de metodologia padrão
A CONITEC se serve da REBRATS (Rede Brasileira de Avaliação em Tecnologia em Saúde) para a elaboração de pesquisas e relatórios. Sua finalidade é "proceder à geração e à síntese e disseminação de evidências científicas no campo de Avaliação de Tecnologias em Saúde (ATS) no Brasil e no âmbito internacional" (art. 1º, do seu Regimento Interno). Tais estudos serão levados a cabo "nas fases de incorporação, monitoramento e exclusão de tecnologias no âmbito do SUS" (art. 2º).
Fazem parte da REBRATS os NATs (Núcleos de Avaliação de Tecnologias em Saúde), que são responsáveis pelas análises feitas pela CONITEC. Ao todo, existem 24 NATs3.
Para que haja uma uniformidade nos processos da CONITEC, a REBRATS possui manuais de diretrizes metodológicas, tanto no que diz respeito à coleta de evidências e elaboração de relatórios, bem como no que se refere à avaliação econômica das tecnologias em saúde4.
Todavia, o que se pode perceber é que alguns relatórios da CONITEC ainda não obedecem aos critérios formais e materiais dos manuais existentes.
A falta de padronização se refere precipuamente à parte econômica dos relatórios. Existem relatórios que não possuem análise de custo-efetividade, a exemplo da Alteplase, da Miltefosina e da Eltrombopague. O estudo de custo-efetividade é imposição legal (parágrafo único, do art. 19-O, da lei 8.080/90) e não poderia ser deixado de lado, ainda que o ente demandante seja o próprio poder público.
Outros relatórios deixam de considerar o horizonte temporal recomendado pela REBRATS para a avaliação de impacto orçamentário, que é de 3 a 5 anos5, como o do Ipilimumabe e o do Cloridrato de Clindamicina e Rifampicina.
Também há aqueles que, para analisar o impacto orçamentário, deixam de considerar os custos evitados com a substituição de uma terapia já disponível pela sua desincorporação.
Tal ausência de rigor metodológico foi ressaltada por Patricia Coelho de Soarez e Hildegonda Maria Dutihl Novaes6, em artigo que trata de limiares de custo-efetividade.
Assim, seria de grande importância exigir o rigor metodológico e formal na elaboração dos relatórios feitos pela CONITEC.
5.2 Atribuir maior transparência na escolha do NATs
Conforme se extrai do site da REBRATS, existem 24 NATs que auxiliam a CONITEC em seus relatórios. No entanto, não se sabe que instituições os representam. Tampouco se sabe qual deles elabora determinado relatório.
Essa ausência de identificação traz problemas de duas ordens: 1) não saber como é feita a escolha dos NATs ou de outras instituições para a elaboração dos relatórios; e 2) não trazer uma maior responsabilidade para quem está elaborando a pesquisa.
A expressa indicação da instituição elaboradora no relatório traria uma maior transparência e legitimidade no processo de escolha. Poder-se-ia verificar que o NAT escolhido possui expertise em determinada área e que está havendo um rodízio entre os núcleos.
Porém, a maior contribuição em relação à identificação do elaborador no relatório diz respeito à carga de responsabilidade que isso implicaria. O NAT escolhido, sabedor de que seu nome irá estampar o relatório, pode entender que tem maior responsabilidade na sua elaboração, possuindo até mesmo maiores argumentos para afastar influências políticas existentes no processo. Assim, possivelmente haveria maior preocupação com o rigor científico na elaboração dos relatórios.
Certamente a anonimização prévia é necessária para proteger os NATs de pressões por parte da indústria farmacêutica ou associações da sociedade civil. Todavia, nada impede que o nome seja divulgado posteriormente, com a publicação do relatório.
Aliás, essa prática já vem sendo utilizada em alguns protocolos elaborados pelo Hospital Oswaldo Cruz e deve ser ampliada.
5.3 Deixar de negar incorporação de drogas com base no sistema da APAC-ONCO
Algumas drogas não são incorporadas, sob o fundamento de que não haveria necessidade para tanto, haja vista o sistema de pagamento da oncologia se dar por APAC (Autorização de Procedimento de Alta Complexidade).
Grosseiramente, os diversos tratamentos de câncer possuem um código diferente de procedimento referente à APAC. Cada APAC possui um valor, e todos os custos do tratamento do paciente oncológico em determinado período de tempo têm de caber no valor fixado.
Os serviços hospitalares que tratam pacientes oncológicos podem prescrever o que acharem mais recomendável. Com base nessa liberdade de prescrição, a CONITEC, por vezes, deixa de incorporar uma tecnologia, alegando que a incorporação é desnecessária.
Eis a transcrição da recomendação preliminar da CONITEC quando da análise do Sorafenibe:
"A CONITEC em sua 64ª reunião ordinária, nos dias 7 e 8 março de 2018, esclareceu a dinâmica do tratamento oncológico, onde o procedimento APAC de tratamento do carcinoma hepatocelular não inviabiliza o uso do medicamento sorafenibe por pacientes no âmbito do SUS. E considerou não há a necessidade de criação de um novo procedimento APAC específico para a incorporação do sorafenibe nos esquemas quimioterápicos utilizados no SUS para o tratamento do CHC avançado irressecável em monoterapia na quimioterapia paliativa."
Nessa situação, a CONITEC fecha os olhos ao fato de que os serviços não possuem total liberdade na prescrição do tratamento. A liberdade que existe é limitada ao custo da APAC. Se um medicamento custa mais do que o valor da APAC, não há possibilidade de sua indicação.
É exatamente isso que ocorre com o Sorafenibe. Seu valor supera em muito o valor da APAC. É evidente, então, que os prescritores não possuem liberdade para prescrevê-lo. Logo, existe a necessidade de incorporação para que a droga seja disponibilizada nesses casos. A justiticativa acima só pode ser adotada caso fique comprovado que o valor da APAC suporta o custo do medicamento em análise.
Fica claro então que a CONITEC não pode se esquivar da decisão com base nesse argumento. Não se está querendo dizer que o Sorafenibe deveria ser incorporado, mas sim, que a recomendação para a sua não incorporação deve ser plausível.
5.4 Fixar liminares de custo-efetividade e de impacto orçamentário
A adoção de limites de custo-efetividade e de impacto orçamentário é medida que se impõe em razão da limitação orçamentária a que todos os sistemas de saúde públicos estão sujeitos. Seu objetivo é dar maior racionalidade no processo de tomada de decisões.
Os países podem adotar limiares explícitos (expressamente fixados) ou implícitos (sem fixação formal, mas passíveis de dedução pela análise dos relatórios de incorporação). No Brasil, o que se percebe é que não existem limiares explícitos, nem implícitos.
Entretanto, num país em que a democracia ainda não é madura, a adoção de um limite explícito se faz necessária, principalmente em vista dos princípios de direito administrativo. O limite explícito confere transparência e possibilidade de controle. A ausência de limiar explícito, por sua vez, pode favorecer arbitrariedades e desigualdades em relação aos usuários do SUS.
O Brasil, na classificação de Francis Fukuyama, caracteriza-se como uma sociedade de baixa confiança. Nesse tipo de sociedade, as regras devem ser claramente definidas, a fim de garantir credibilidade à atuação do poder público e das organizações em geral. Nas palavras do citado autor:
"By contrast, people who do not trust one another will end up cooperating only under a system of formal rules anda regulations, which have to be negotiated, agreed to, litigated, and enforced, sometimes by coercive means. This legal apparatus, serving as a substitute for trust, entails what economists call "transaction costs". Widespread distrust in a society, in other words, imposes a kind of tax on all forms of economic activity, a tax that high-trust societies do not have to pay."7
A fixação de limiares, ainda que possa gerar descontentamento ou críticas, acaba por conferir maior credibilidade nas escolhas políticas em matéria de saúde. É importante ressaltar que não precisa haver um único limiar, mas podem ser adotados limiares múltiplos e elásticos, tal como fez o Reino Unido.
Contra a utilização de limiares explícitos, pode-se argumentar que eles permitiriam que a indústria farmacêutica trabalhasse com seus preços até que os limiares fossem atingidos. Todavia, tal argumento, do ponto de vista jurídico, não é suficiente para dispensar a explicitação da regra.
Aliás, a falta de adoção de limiar pode levar ao mesmo problema, com até maior gravidade, na medida em que não haverá teto.
Assim, caso se perceba um abuso por parte da indústria farmacêutica, o SUS deve se posicionar e agir com maior rigor, haja vista o seu enorme potencial consumidor, na medida em que serve a mais de 200 milhões de pessoas.
5.5 Explicitar os motivos que levaram à alteração do relatório preliminar
O decreto 7.646/11 prevê que o relatório preliminar feito pela CONITEC será levado à consulta pública. Com a análise das contribuições, haverá a sua finalização. Seu artigo 19, §2º estabelece que:
"§ 2º As contribuições e sugestões recebidas no âmbito da consulta pública serão organizadas pela Secretaria-Executiva da CONITEC e encaminhadas para análise, em regime de prioridade, pelo Plenário, que as examinará, com a respectiva fundamentação."
Como o próprio decreto estabelece, o plenário da CONITEC deve examinar as contribuições e sugestões "com a respectiva fundamentação". Ainda que não houvesse essa previsão, a fundamentação é inafastável razão da imposição de motivação dos atos administrativos. Ela é ainda mais relevante quando ocorre a alteração da recomendação preliminar (conforme art. 50, I e VII, e parágrafo primeiro, da lei 9.784/99).
Não obstante, há inúmeros relatórios que não fazem nenhuma consideração acerca das contribuições trazidas na consulta pública, o que leva à produção de ato administrativo sem explicitar as razões determinantes para a sua edição.
Se é feito um relatório pela não recomendação de uma dada tecnologia por não haver evidências suficientes em relação à sua superioridade, não há como modificar apenas a conclusão do relatório sem apontar os motivos que levaram a tanto. O ato carece de fundamentação e, portanto, não possui validade.
Marçal Justen Filho, ao tratar do ato administrativo, explica que "um dos requisitos mais relevantes relaciona-se com a motivação, expressão que indica a exposição pública e expressa das razões que conduziram o agente a produzir certo ato administrativo. Essa motivação deve compreender a explicitação não apenas dos motivos eleitos pelo administrador, mas também das finalidades por ele buscadas de modo concreto".
Adiante, o autor acrescenta que "a motivação é relevante tanto no tocante a competências discricionárias como quanto a escolhas vinculadas. Na hipótese de discricionariedade, a atribuição pela norma de autonomia de escolha para o agente não significa ausência de controle ou limite. (...) Decisão discricionária não motivada é ato arbitrário, desconforme ao direito, incompatível com a democracia republicana. Não pode ser legitimado com o argumento de que o agente tinha liberdade de escolher, porque essa liberdade não corresponde à autonomia privada. A autonomia do agente, existente na hipótese de discricionariedade, destina-se ao melhor desempenho possível da função administrativa"8.
Sobre o tema, veja-se a opinião de Denizar Vianna Araujo:
"Decisões de cobertura relativas a novas tecnologias e serviços inevitavelmente criam vencedores e perdedores. Por isso, a transparência dos processos usados para informar essas decisões é fundamental para assegurar justiça e legitimidade em tais decisões. A falta de informação detalhada e acessível sobre os critérios utilizados pelo Ministério da Saúde para suas deliberações faz com que muitos atores permaneçam críticos. Logo, é necessário criar mecanismos para assegurar que os processos de ATS e de tomada de decisão sejam vistos como transparentes pelos diversos grupos de interesse."9
Dessa maneira, é necessário que sempre sejam declinadas as razões para a recomendação feita. Da mesma forma, o Secretário de Ciência, Tecnologia e Insumos Estratégicos deve dizer explicitamente quais os motivos que o levaram a rejeitar a conclusão de um relatório da CONITEC, sob pena de invalidade do ato.
5.6. Evitar decisões teratológicas
Há um relatório emblemático que, sob o enfoque do direito administrativo, é bastante questionável. Trata-se do relatório do Tafamidis. No corpo do relatório, são apontados os seguintes problemas em relação à tecnologia: falta de evidências, relação de custo-utilidade ruim, alto impacto orçamentário, método de análise econômica questionável. Confira-se este trecho:
"Considerações: Baixa confiança na evidência do uso do tafamidis na PAF -TTR, baseada em análise secundária de um único ensaio clínico com desfecho que não é crítico para a tomada de decisão clínica. Eficácia comparativa com outras opções terapêuticas não foi avaliada. Análise econômica com validade questionável. Impacto orçamentário com custo significativo."
Diante desse quadro, era de se esperar que houvesse a recomendação pela não incorporação do medicamento. Todavia, já no relatório preliminar, contrariando as análises feitas, o plenário da CONITEC recomendou a sua incorporação, o que foi mantido no relatório final.
Juridicamente, essa incorporação está eivada de vícios que não podem ser validados. Uma vez que os motivos expostos estão em clara contradição com a conclusão, pode-se dizer que, em verdade, o ato é desprovido de fundamentação, dando margem à sua anulação pelo Poder Judiciário. O tema será melhor abordado adiante.
5.7 Assegurar decisões coerentes e compatíveis com o entendimento adotado em processos similares
Outro cuidado que se relaciona com a adoção de metodologias padronizadas consiste na adoção de decisões que sejam compatíveis e coerentes com o entendimento adotado em outros processos similares.
Trata-se de exigência que deriva da LINDB (dec.-lei 4.657/42). Nos termos do art. 24 da LINDB, tanto a Administração como os órgãos de controle devem considerar "as orientações gerais da época", que consistem, segundo o parágrafo único, em "interpretações e especificações contidas em atos públicos de caráter geral ou em jurisprudência judicial ou administrativa majoritária, e ainda as adotadas por prática administrativa reiterada e de amplo conhecimento público".
Ou seja, as decisões devem seguir uma determinada linha coerente. A existência de discrepâncias não justificadas poderá indicar irregularidade ou desvio a ser investigado.
5.8 Estabelecer mecanismos que evitem a aprovação excessiva de incorporações em final de mandato
Por fim, é necessário que sejam estabelecidos mecanismos para evitar que haja uma quantidade excessiva de incorporações em final de mandato, a fim de que a gestão futura não venha a ser prejudicada com decisões precipitadas, tomadas sem a devida ponderação com relação aos impactos que elas podem causar.
No ano de 2018, a CONITEC analisou 104 relatórios, tanto de incorporação, como PCDTs e DDTs. Desses relatórios, 24 tiveram decisão do Secretário em dezembro de 2018, sendo que 13 foram pela aprovação, incorporação ou ampliação de uso de novos tratamentos.
Eculizumabe, Alfaelosulfgase e Galsulfase foram aprovados em fim de mandato. Como já visto, esses são medicamentos que causarão enorme impacto orçamentário ao SUS, problema esse que terá de ser resolvido pelo novo gestor.
6. A confiabilidade das decisões da Conitec e o controle de seu atos pelo Judiciário
Em que pese a relevância da CONITEC e o seu esforço em aprimorar seus atos, as falhas apontadas acima revelam que ainda há muito a ser melhorado.
A confiança que se tem na atuação e decisões adotadas por um órgão é diretamente proporcional à qualidade de seu trabalho. Assim, quanto mais adequados, fundamentados e coerentes forem os relatórios da CONITEC, mais credibilidade ela terá, tanto perante o Poder Judiciário, como perante a sociedade em geral.
Hildegonda Maria Dutilh Novaes e Patrícia Coelho de Soárez apontam que "A reputação e a credibilidade de uma agência, envolvimento dos stakeholders e qualidade dos produtos (relatórios, pareceres, estudos) apresentados são apontados na literatura como os aspectos mais importantes para obtenção de maior impacto da agência de ATS"10.
Uma pesquisa do INSPER publicada neste ano de 2019 demonstra que a CONITEC é citada em menos de 0,51% das decisões de demandas em saúde. Já os PCDTs são citados em 5,83% das decisões11.
A desconsideração do órgão pelo Poder Judiciário se deve a vários fatores, inclusive ao desconhecimento dos juízes de sua existência. Todavia, falhas em sua atuação também podem ter sido em parte determinantes para o resultado da pesquisa.
Em vista disso, a CONITEC tem de enfrentar o desafio de construir melhores relatórios e decisões, principalmente considerando que ela, em última análise, dá concretude ao direito constitucional à saúde, que é um dos mais caros ao nosso ordenamento jurídico.
O Poder Judiciário também pode contribuir com esse desafio, exercendo o controle externo das decisões administrativas, no que diz respeito a questões jurídicas. A atuação nesse sentido seria mais significativa e estruturante do que a maneira com que o SUS vem sendo demandado em matéria de saúde.
Em que pese a incorporação de tecnologias em saúde tenha uma grande dose de discricionariedade, o seu controle pode ser feito pelo Poder Judiciário, conforme explica novamente Marçal Justen Filho:
"A amplitude do controle da legalidade é muito maior, já que existe uma norma estabelecendo os pressupostos ou o conteúdo do ato objeto de controle. Enquanto isso, o controle de mérito é muito mais limitado, porque o direito reconhece ao agente o poder de realizar escolhas segundo a própria avaliação de conveniência e oportunidade. Isso não significa a inviabilidade do controle sobre o mérito do ato, sendo cabível verificar se o sujeito adotou todas as precauções necessárias para praticar um ato adequadamente e se orientou a sua conduta à obtenção das finalidades previstas pela ordem jurídica."12
Note-se que, no caso de ficar configurada a invalidade do ato, ao Poder Judiciário cabe somente a sua desconstituição ou a determinação ao agente administrativo para que produza novo ato administrativo, em uma situação a que o doutrinador se refere como "constituição indireta"13.
7. Conclusões
As avaliações de tecnologia em saúde no SUS estão em constante aprimoramento. A lei 12.401/11 e o decreto 7.646/11 trouxeram importantes avanços.
Tendo em vista que a discussão e a regulamentação do processo de incorporação de tecnologias ainda são muito recentes, é natural que haja falhas. Todavia, é necessário o exame objetivo e crítico a respeito de decisões anteriormente proferidas, de modo que seja possível melhorar os métodos e aperfeiçoar o processo.
Com isso, o resultado das decisões torna-se mais transparente, estável e menos suscetível tanto a pressões políticas e de mercado, como à revisão judicial. Em consequência, os atos praticados pela CONITEC e SCTIE serão mais respeitados e gerarão menos desconfiança por parte da sociedade.
Isso não significa que aqueles que discordem não possam formular seus questionamentos, mas sim que a tendência é de diminuir a litigiosidade, inclusive a judicialização da saúde.
Para que o processo administrativo seja aprimorado, o Poder Judiciário pode exercer importante papel, desde que demandado, produzindo o controle de atos, preferencialmente em processos coletivos. A utilização da via coletiva questionando atos praticados no processo de incorporação certamente se mostra mais útil ao SUS e aos seus usuários do que a multiplicação desenfreada de demandas individuais, que passam ao largo de todas as questões atinentes ao processo da CONITEC.
_____________
1 - Wang, Daniel Wei L. From Wednesbury Unreasonableness to Accountability for Reasonableness. The Cambridge Law Journal, vol. 76, Issue 3, November 2017, p. 642-670.
2 - A unidade de resultado em saúde que combina ganho (ou perda) na sobrevida com qualidade de vida são os anos de vida ajustados por qualidade (QALY / quality-adjusted life years). Os QALY representam os anos de vida subsequentes a uma intervenção de saúde, ajustados para a qualidade de vida experimentada pelo paciente durante esses anos. Por definição e em sua forma mais simples, a especificação da função agregada proposta pelo método QALY, usado para agregar um ganho de t anos de vida em um estado de saúde cuja qualidade é mensurada pelo valor q, é igual ao período t multiplicado pela qualidade de vida q. Os QALY fornecem uma unidade comum para comparar o custo-utilidade de diferentes intervenções de saúde e para estabelecer prioridades para a alocação de recursos exíguos e têm sido amplamente utilizados na literatura internacional. Estudos de Avaliação Econômica de Tecnologias em Saúde, Diretrizes Metodológicas, Ministério da Saúde, 2009. Disponível em: Clique aqui.
3 - Informação extraída do link Clique aqui.
4 - Os manuais podem ser encontrados no link: https://rebrats.saude.gov.br/diretrizes-metodologicas.
5 - Diretrizes metodológicas: análise de impacto orçamentário : manual para o Sistema de Saúde do Brasil / Ministério da Saúde, Secretaria de Ciência, Tecnologia e Insumos Estratégicos. Departamento de Ciência e Tecnologia. - Brasília: Ministério da Saúde, 2012. https://rebrats.saude.gov.br/diretrizes-metodologicas?download=67:livro-manual-de-impacto-orcamentario.
6 - "Além do pequeno número, as avaliações econômicas apresentaram razões heterogêneas ($/QALY, DALY ou anos de vida) e distantes do padrão internacional esperado de qualidade metodológica." NOVAES, H. M. D.; DE SOAREZ; P. C. Limiares de custo-efetividade e o Sistema Único de Saúde. Cadernos de Saúde Pública, 2017, p. 1-5. Disponível no endereço eletrônico: Clique aqui.
7 - Trust. The Social Virtues and the Creation of Prosperity. Free Press Paperbacks, 1996, p.27.
8 - Curso de Direito Administrativo, RT, 13ª ed. p. 355.
9 - Material de apoio do curso de Saúde Baseada em Evidências e as Decisões Judiciais, Módulo 7, desenvolvido em parceria com o CNJ, o Hospital Sírio-Libanês e o Ministério da Saúde.
10 - Organizações de avaliação de tecnologias em saúde (ATS): dimensões do arcabouço institucional e político. Cadernos de Saúde Pública, vol. 32, supl. 2, 2016. Disponível no link Clique aqui.
11 - Clique aqui.
12 - Curso de Direito Administrativo, RT, 13ª ed. p. 1110.
13 - Curso de Direito Administrativo, RT, 13ª ed. p. 1119/1120.
_____________
*Ana Carolina Morozowski é juíza federal substituta da 3ª Vara Federal de Curitiba e especializada em saúde.



